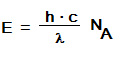Chemische und physikalische Grundlagen der Schwarz-Weiß-Silberfotografie
von Jens Vogel (2010)
Die Belichtung des Filmmaterials
a. Modellvorstellung zum photochemischen ElementarprozessDie genauen Abläufe bei der Belichtung sind bis heute noch nicht in allen Einzelheiten geklärt. Die unten dargestellten Modellvorstellungen versuchen die Vorgänge des Belichtungsprozesses verständlich und anschaulich zu erklären und wurden teilweise vereinfacht, trotzdem wurde auf wissenschaftliche Exaktheit geachtet.
Die klassische Silberfotografie beruht auf der Lichtempfindlichkeit der Silberhalogenide (Silberchlorid, Silberbromid und Silberjodid), chemische Verbindungen des Silbers mit den Halogenen Chlor,Brom oder Jod. Am häufigsten kommt das Silberbromid als lichtempfindliche Verbindung zum Einsatz. Durch Lichteinwirkung werden die Silberhalogenide in ihre Elemente zerlegt, also in elementares Silber und die Halogene. Elementares Silber ist in feinverteilter Form schwarz. Hierdurch wird die fotografische Schicht je nach Intensität der Lichteinwirkung an verschiedenen Stellen mehr oder weniger stark geschwärzt.
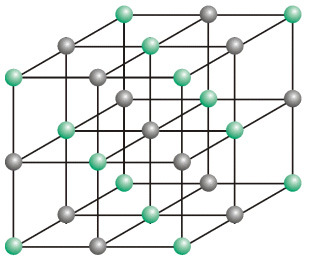
Das Filmmaterial besteht meistens aus Cellulose-Acetat (Acetylcellulose) oder auch Polyester als Trägermaterial. Auf diesen Träger wird eine dünne Schicht aus Gelatine aufgebracht, in die feinverteiltes Silberbromid als Suspension eingelagert ist. Silberbromid ist eine weiß-gelbe kristalline Substanz (Salz), welches aus einfach positiv geladenen Silber-Ionen und einfach negativ geladenen Bromid-Ionen besteht. Diese Ionen bilden in kristalliner Struktur ein sog. Ionengitter aus (Gitterstruktur), in dem dreidimensional in die drei Raumachsen abwechselnd positive und negative Ionen angeordnet sind. Die Silberbromid-Emulsion *(s.u.) stellt man her, indem man wässrige Lösungen von Silbernitrat und Kaliumbromid in eine Gelatine-Lösung einfließen lässt. In einer Fällungsreaktion bildet sich das schwer-lösliche Silberbromid. Die Bildung der feinen AgBr-Mikrokristalle erfolgt dabei direkt in der Gelatine-Lösung, und es wird so verhindert, dass sich größere Kristalle durch Koagulation zusammenballen können. Die Größe der Kristalle und die Kristallform (Oktaeder, Tetrade-kaeder, Kuben, Tafeln) sind steuerbar und haben eine besondere Bedeutung für die Lichtempfindlichkeit der Emulsion.
* (In der Fotografie spricht man meistens von einer Emulsion, eine Bezeichnung, die historisch entstanden ist. Der Begriff ist aber streng genommen falsch, es handelt sich um eine Suspension).Salze sind nie ideal kristallisiert (hypothetische "Idealkristalle"), sondern weisen immer, je nach Reinheit, mehr oder weniger viele Gitterstörstellen auf, d.h., es können z.B. im Gitter Leerstellen vorhanden sein oder freie Gitterplätze werden von gleich großen Fremdionen (z.B. durch Verunreinigungen) besetzt ("Realkristalle"). Hier bieten sich wegen ihrer Größe besonders die aus der Gelatine stammenden Selen- oder Sulfid-Ionen an. Die Sulfidionen sind im Gegensatz zu den Bromid-Ionen doppelt negativ geladen, erzeugen also einen negativen Ladungsüberschuss an dieser Stelle. Das bedeutet, dass in ihrer Umgebung positiv geladene Silberkationen aus dem AgBr-Gitter vermehrt angezogen werden.
In einer anderen Theorie verlassen einige Silberionen ihren Stammplatz, wandern durch den Kristall und verweilen dabei kurzzeitig auf Zwischengitterplätzen. Auch hierdurch ist die Idealstruktur des Kristalls gestört.
Diese Gitterstörstellen sind in der Silberbromid-Schicht erwünscht, sie begünstigen die Bildung der Belichtungskeime (s.u.). Durch Zugabe von Fremdsalzen, wie z.B. Silbersulfid oder Goldsulfid, wird die Idealstruktur des Silberbromids zusätzlich gezielt gestört, wodurch die Empfindlichkeit erheblich zunimmt.Trifft nun ein Lichtquant (Photon) auf ein AgBr – Gitter (Photon mit der Energie hf ** - s.u.) , „schlägt“ es aus einem negativ geladenen Bromid-Ion ein Elektron heraus (Photoelektron):
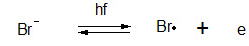
Zurück bleibt ein ungeladenes Bromradikal (Bromatom), welches in die Gelatine abwandert und sich dort mit irgendwelchen anderen Atomen oder Molekülen verbindet (absättigt).
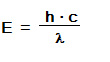 bzw.
bzw.